核心提示:近日,我校动科动医学院申邦教授课题组发现了弓形虫AMP激活的蛋白激酶(AMPK)对虫体寄生生活中代谢活动的关键调控作用与机制。
近日,我校动科动医学院申邦教授课题组在Nature Communications上发表了题为“Rapid metabolic reprogramming mediated by the AMP-activated protein kinase during the lytic cycle ofToxoplasma gondii”的研究论文,报道了弓形虫根据寄生环境的变化调节AMPK的活性,进而调控虫体的代谢活动,使得虫体在感染宿主细胞时各个阶段的代谢需求都得到满足,并且AMPK这种代谢重编程作用对虫体建立寄生生活是必须的。
弓形虫是广泛分布的人兽共患寄生原虫,感染了世界上三分之一的人口和猪、牛、羊、禽等无数温血动物,虫体具有强大的环境适应能力,能够在极其多样的宿主和细胞条件下建立寄生生活。申邦教授课题组近年来一直致力于弓形虫适应寄生生活的代谢规律与调控机制研究,以发掘有价值的靶标开展药物与疫苗研制。弓形虫是专性胞内寄生原虫,入侵宿主细胞后在宿主细胞内繁殖复制并最终裂解宿主细胞,急性弓形虫病即是由虫体反复入侵、增殖并裂解宿主细胞导致的。在这个裂解循环中,虫体经历2个阶段:一个短暂的胞外期,虫体主要依靠自身的滑行运动寻找并入侵宿主细胞;一个胞内期,虫体在细胞内经内出芽不断繁殖复制,当虫体复制到一定数量(>64个虫体)时,虫体裂解宿主细胞并从中逸出,启动滑行运动并开始下一个裂解周期。虫体在这两个阶段具有截然不同的代谢活性与代谢需求,但是经由什么机制来调控虫体的代谢活动以满足不同时期的代谢需求却完全不清楚。
在这项工作中,研究人员发现弓形虫中的AMPK复合物对裂解循环中虫体的代谢活动有关键调控作用,其催化亚基AMPKα的磷酸化水平在胞内期虫体中较低,当虫体逸出到胞外时,AMPKα磷酸化水平迅速升高并激活AMPK复合物。AMPK被激活后调控多个代谢通路的活性,使得虫体的代谢以生产能量的分解代谢为主。虫体入侵宿主细胞后,AMPKα的磷酸化水平下降,AMPK活性降低,虫体中生成大分子的合成代谢和产生能量的分解代谢之间取得良好的平衡,使虫体可以在宿主细胞内高效利用获取的营养快速繁殖复制(图1)。通过构建转基因虫株模拟AMPKα磷酸化状态的改变,研究人员发现AMPKα在胞内与胞外期交替磷酸化与去磷酸化对虫体生长和完成裂解循环至关重要。
AMPK是真核生物中广泛存在的一个代谢调节因子,然而从酵母到人和小鼠细胞,AMPK在细胞水平上都不是必需的,但是AMPK对多细胞生物的胚胎发育等过程非常关键,因此在个体水平是必需的。弓形虫作为单细胞的原生动物,既是细胞,又是个体,因此这项研究还提示弓形虫可以成为研究AMPK在个体水平上生物学功能的模式生物,AMPK在弓形虫中不可或缺的特征也印证了这一点。同时,申邦教授课题组近期发表的另一项工作报道了AMPK在弓形虫分化发育中的关键调控作用(Jichao Yanget al., Cell Mol Life Sci. 2022),进一步说明AMPK工作模式的多样性。
本研究发现了AMPK对弓形虫代谢活动的关键调控作用,为弓形虫病的防控提供了新的靶标。鉴于AMPK在高等生物代谢活动中的重要作用,目前已经开发了许多靶向AMPK来治疗人类疾病(如糖尿病、肥胖等)的小分子化合物,本研究也证明了其中部分化合物对弓形虫有很好的抑制效果,表明后续可以筛选优化这些已知的化合物来发掘抗弓形虫新型药物,甚至实现“一药治多病”的目的。
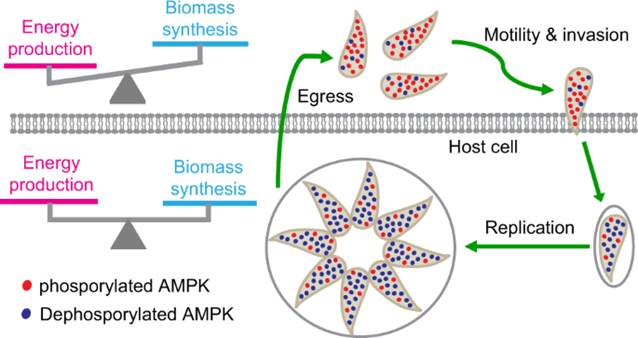
图1. AMPK在弓形虫裂解循环中的代谢重编程作用与机制模型.
开元·体育(中国)官方网站动科动医学院博士李亚琼为论文第一作者,申邦教授为论文通讯作者。该研究得到了国家自然科学基金中德合作基金(31961133032)和优秀青年科学基金(31822054)的支持。
【英文摘要】
The ubiquitous pathogenToxoplasma gondiihas a complex lifestyle with different metabolic activities at different stages that are intimately linked to the parasitic environments. Here we identified the eukaryotic regulator of cellular homeostasis AMP-activated protein kinase (AMPK) inToxoplasmaand discovered its role in metabolic programming during parasite’s lytic cycle. The catalytic subunit AMPKα is quickly phosphorylated after the release of intracellular parasites to extracellular environments, driving energy-producing catabolism to power parasite motility and invasion into host cells. Once inside host cells, AMPKα phosphorylation is reduced to basal level to promote a balance between energy production and biomass synthesis, allowing robust parasite replication. AMPKγ depletion abolishes AMPKα phosphorylation and suppresses parasite growth, which can be partially rescued by overexpressing wildtype AMPKα but not the phosphorylation mutants. Thus, through the cyclic reprogramming by AMPK, the parasites’ metabolic needs at each stage are satisfied and the lytic cycle progresses robustly.
原文链接:https://www.nature.com/articles/s41467-023-36084-0
通讯员:李亚琼
审核:申邦

